
Investigadors del CNIO han utilitzat la criomicroscopía electrònica per a descriure com es regula el ‘motor energètic’ d’un dels complexos proteics implicats en càncer, una potencial diana per a reduir el creixement de tumors.
Se sol dir que les proteïnes són els maons amb els quals es construeix la vida. A l’interior de les cèl·lules, les proteïnes s’associen en grans complexos macromolècules, consorcis de proteïnes que cooperen per a dur a terme funcions específiques. Moltes recerques del càncer se centren a trobar inhibidors per a alguns d’aquests complexos proteics, com són les cinases mTOR i ATR o l’enzim telomerasa, que estan sobreactivades en els tumors.
Existeixen unes proteïnes la funció de les quals és construir aquests complexos (les trucades chaperonas i cochaperonas) i la inhibició d’aquest procés d’assemblatge s’està estudiant com a estratègia contra el càncer. Podria dir-se que cinases i enzims com mTOR, ATR o la telomerasa són un edifici en construcció i les chaperonas (com HSP90) i cochaperonas (com R2TP), les maquinàries que el construeixen.
Les evidències actuals suggereixen el potencial terapèutic de RUVBL1-RUVBL2, el motor energètic de la cochaperona R2TP, en el tractament contra el càncer. Ara, investigadors del Grup de Complexos Macromoleculars en la Resposta a Danys en l’ADN del Centre Nacional de Recerques Oncològiques (CNIO) han utilitzat el poder de la criomicroscopía electrònica per a determinar el mecanisme que regula RUVBL1 i RUVBL2. El treball es publica en Science Advances.
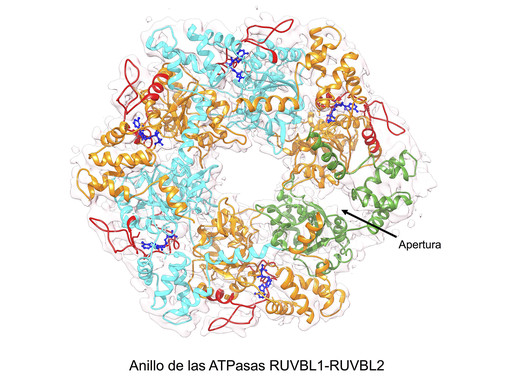
El Grup del CNIO ja havia utilitzat la criomicroscopía electrònica per a observar l’estructura a alta resolució de R2TP. En aquell treball, els investigadors van observar com R2TP està dissenyat per a posar en contacte a la chaperona HSP90 amb les proteïnes sobre les quals ha d’actuar. R2TP compta amb un motor d’energia, un anell format per les ATPasasRUVBL1 i RUVBL2, que utilitzen l’energia proporcionada per l’ATP mitjançant la seva hidròlisi a ADP.
L’estudi de complexos macromoleculars mitjançant criomicroscopía electrònica està revolucionant la capacitat de comprendre com funcionen les proteïnes
El Grup del CNIO ja havia utilitzat la criomicroscopía electrònica per a observar l’estructura a alta resolució de R2TP. En aquell treball, els investigadors van observar com R2TP està dissenyat per a posar en contacte a la chaperona HSP90 amb les proteïnes sobre les quals ha d’actuar. R2TP compta amb un motor d’energia, un anell format per les ATPasas RUVBL1 i RUVBL2, que utilitzen l’energia proporcionada per l’ATP mitjançant la seva hidròlisi a ADP.
En aquest procés de generació d’energia, les ATPasas recullen l’ATP present en la cèl·lula i alliberen ADP com a deixalla i energia. En el cas de l’anell format per RUVBL1 i RUVBL2, els investigadors observaven que l’accés al centre d’unió de l’ATP estava completament tancat, atrapant l’ATP o ADP en el seu interior i impedint el seu intercanvi i amb això el funcionament del motor. La pregunta que sorgia era com s’utilitza l’energia necessària per a l’assemblatge de complexos proteics.
La criomicroscopía electrònica ha permès buidar aquesta incògnita: “Hem detectat una regió de la proteïna RUVBL2 que funciona a manera de porta que s’obre per a permetre l’accés de l’ATP i ADP a la proteïna, i amb això l’alliberament de l’energia continguda en l’ATP”, explica Óscar Llorca, cap del Grup del CNIO. “La clau que regula l’obertura d’aquesta porta és la interacció de la ATPasa RUVBL2 amb un component de R2TP necessari per a l’assemblatge de mTOR”.
Revolució en el funcionament de les proteïnes
L’estudi de l’estructura i dinàmica de proteïnes –aquell que analitza com interactuen les proteïnes entre si per a dur a terme totes les funcions biològiques en les quals estan implicades– sempre ha mostrat una gran dificultat, tant amb observacions experimentals com amb eines computacionals. En aquest sentit, l’estudi de proteïnes i complexos macromoleculars mitjançant criomicroscopíaelectrònica està revolucionant la capacitat d’observar i comprendre com funcionen les proteïnes, tal com apuntava fa uns mesos la revista Nature.
Aprofundir en el funcionament dels processos que determinen si es construeixen o no certes molècules fonamentals en càncer pot ajudar a trobar noves estratègies terapèutiques basades en la inhibició de l’assemblatge de proteïnes. En el cas de les ATPasas RUVBL1 i RUVBL2, ja hi ha estudis tractant d’inhibir la seva activitat promotora de tumors. Els resultats que ara publica en Science Advancesl’equip que lidera Llorca, en col·laboració amb el grup de Laurence H. Pearl en la Universitat de Sussex (Regne Unit), permetran afinar aquests treballs.
“Sabem que l’energia de l’ATP és utilitzada per les ATPasas RUVBL1 i RUVBL2 i que és necessària per a l’assemblatge de mTOR i altres complexos macromoleculars, però desconeixem com i en què s’usa energia”, diu Llorca.
“En aquest article hem descobert que RUVBL2 disposa d’una comporta per a controlar l’accés de l’ATP al centre catalític on la seva energia és utilitzada. Observem a més que l’obertura d’aquesta comporta està controlada per molècules necessàries per a l’assemblatge de mTOR, acoblant l’activació del motor al moment en què l’energia és necessària. Però encara no sabem en què s’empra exactament aquesta energia. En pròxims estudis investigarem per a què és necessari exactament aquesta despesa d’energia en l’àmbit molecular”, conclou.
Font: SINC
(41)









